新冠病毒引发的传染性肺炎COVID-19已经蔓延全球,世界卫生组织(WHO)将其列为全球性流行病。在中国、韩国、日本等部分国家,新冠肺炎的传播得到一定程度的遏制,但是由于没有特效药和疫苗,全球的抗疫局势仍然不容乐观。与17年前的非典肺炎(SARS)类似,新冠肺炎是由冠状病毒引发的,其基因组与SARS病毒有较高相似度,因此,这个病毒被命名为SARS-CoV-2。研究结果表明,SARS-CoV和SARS-CoV-2病毒入侵细胞的主要受体蛋白都是人体细胞的血管紧张素转换酶2(简称ACE2)。病毒表面的棘突蛋白与ACE2紧密结合之后,再融合到人体细胞内,实现入侵和复制,进而感染其他健康细胞。因此,切断或干扰病毒的棘突蛋白与ACE2的相互作用对于阻止病毒入侵至关重要。
多肽分子是由氨基酸脱水形成的以肽键连接的高分子,通常是蛋白质水解的中间产物,若具有稳定结构,理论上可以在细胞内较长时间存在。北京计算科学研究中心刘海广研究组与北京大学光学成像中心苏晓东实验室合作,通过分析晶体结构和计算机模拟SARS-CoV-2棘突蛋白与人体ACE2的结合模式和动态相互作用,以人体ACE2蛋白为蓝本,设计多肽分子,为发展多肽类型的干扰新冠病毒入侵细胞的药物提供重要信息(doi.org/10.1101/2020.05.03.075473)。
棘突蛋白受体结合域(RBD)与ACE2受体的复合物晶体结构以及前期的计算机模拟显示人体ACE2蛋白的N端结构域的螺旋结构与病毒棘突蛋白的结合非常紧密,因此,该研究团队集中筛选ACE2的N端氨基酸肽链,希望从中发现能与病毒结合的亚结构。这些从ACE2蛋白衍生出来的氨基酸肽链不会影响细胞自有的ACE2的表达和功能,如果能够与病毒结合,就可以有效干扰病毒的棘突蛋白与细胞表面的ACE2蛋白的结合,从而抑制病毒的侵入,并且不会带来副作用。按照保留结合位点关键氨基酸的原则,研究人员设计了9条氨基酸肽链(即多肽),并且利用北京超级云计算中心和北京计算科学研究中心的超级计算机,对棘突蛋白的受体结合域(RBD)与这些ACE2衍生多肽的复合物进行了全原子动力学模拟。考虑到这些多肽需要保持其在ACE2全长蛋白质分子中的结构状态才能更有效地与病毒棘突蛋白结合,研究人员针对这些多肽在水溶液中的稳定性进行了研究,以确定其稳定的结构和动力学性质。多肽与病毒棘突蛋白的结合强度则通过模拟复合物在水溶液中的动力学变化进行定量分析。多肽在这两种情况下的螺旋结构含量分别从模拟的结果中计算出来,结果显示较长的多肽能更稳定保持其螺旋结构。通过对复合物的模拟计算,研究人员发现至少三条多肽保持螺旋结构并且稳定结合病毒的棘突蛋白。其中,由ACE2的19至54位置氨基酸组成的多肽的结合能比全长的ACE2更高,具有更好的亲和性,显示出非常好的应用前景。除此以外,还有两条多肽(19-88,21-43)也显示出潜在的应用价值。超级计算机模拟还揭示出多肽不能与棘突蛋白结合的主要因素在于(1)不能保持螺旋结构;(2)设计的多肽缺少重要的氨基酸(主要是ACE2的QAK和LFYQ模体);(3)结构变化导致重要的氨基酸不能同时与棘突蛋白结合。在这个工作的基础上,研究团队正在应用蛋白质工程的方法设计更加稳定的多肽,希望能用于体内干扰病毒感染。
参考文献:
Computational analysis on the ACE2-derived peptides for neutralizing the ACE2 binding to the spike protein of SARS-CoV-2
Cecylia S. Lupala, Vikash Kumar, Xuanxuan Li, Xiaodong Su, Haiguang Liu
bioRxiv 2020.05.03.075473; doi: https://doi.org/10.1101/2020.05.03.075473
Computational simulations reveal the binding dynamics between human ACE2 and the receptor binding domain of SARS-CoV-2 spike protein
Cecylia Lupala, Xuanxuan Li, Jian Lei, Hong Chen, Jianxun Qi, Haiguang Liu, Xiaodong Su
bioRxiv 2020.03.24.005561; doi: https://doi.org/10.1101/2020.03.24.005561
项目组致谢北京超级云计算中心为抗击新冠肺炎无偿提供的计算资源,以及北京计算科学研究中心天河二号超算集群的特批机时。
附图
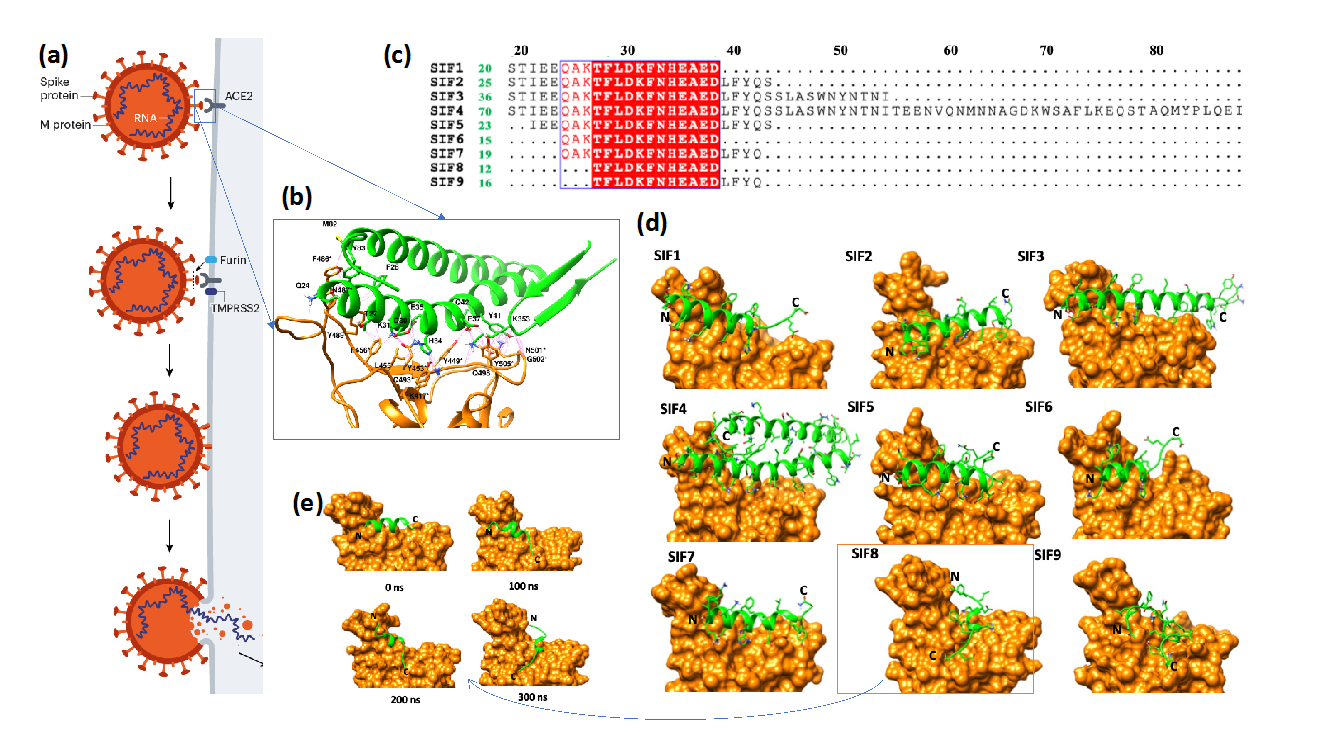
(a) SARS-CoV-2和ACE2蛋白的结合是病毒入侵的第一步;
(b) 病毒棘突蛋白与ACE2结合位置附近的放大图(绿色卡通是ACE2的局部结构,橙色是病毒棘突蛋白的受体结合物);
(c)从ACE2蛋白的N端螺旋筛选出的九个氨基酸链(多肽,绿色数字显示多肽的长度);
(d) 分子动力学模拟的结果,其中SIF3,SIF4,SIF5保持很好的结合状态;
(e) SIF8发生很大的结构变化,失去了大部分的螺旋结构,最终离开结合位点。
(图a根据Nature修改,https://www.nature.com/articles/d41586-020-01315-7)。



